详解 | 巨噬细胞新场景解锁新身份:组织驻留巨噬细胞

巨噬细胞对大家来说并不陌生。
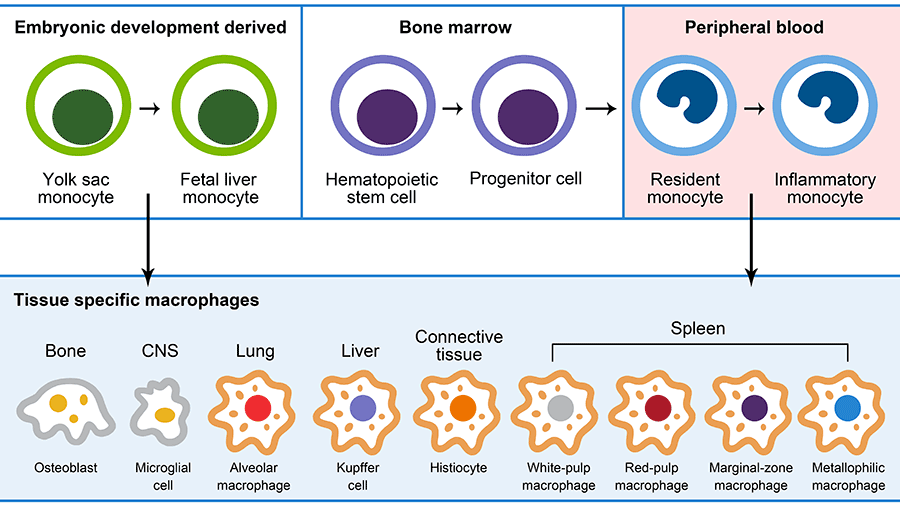
单核细胞由骨髓中的造血干细胞发育而来,并经历几个分化步骤。单核细胞作为常驻单核细胞或有炎症时作为炎性单核细胞迁移到常驻组织中。迁移到组织后,分化为组织驻留巨噬细胞。
巨噬细胞在新场景解锁的新身份,例如骨髓中的巨噬细胞叫破骨细胞(Osteoclast)、中枢神经系统中的巨噬细胞叫小胶质细胞(Microglial cell)、肺脏中的巨噬细胞叫肺泡巨噬细胞(Alveolar macrophage)、肝脏中的叫枯否细胞(Kupffer cell)、结缔组织(Connective tissue)中的叫组织细胞以及脾脏中的叫白髓巨噬细胞、红髓巨噬细胞、边缘区巨噬细胞、嗜金属巨噬细胞等。
以Tissue-resident macrophages为关键词搜索,2013-01至2023-12的文献有 814 篇,文献年均发文量74篇。如下图所示,2021达到年发文量顶峰128篇,2020增长率最快为47.69%,提示该领域的研究得到快速发展,处于快速上升阶段。

2013年1月至2023年12月,Tissue-resident macrophages相关文献的
年度发文趋势
虽然可以通过组合每个组织中的几个泛巨噬细胞标志物(例如CD11b、F4/80、MERTK和CD64)来识别组织驻留巨噬细胞,但不同器官中的每个组织下都有额外的转录程序;这使得通过流式细胞仪分析巨噬细胞亚群的成为可能。
卵黄囊红髓祖细胞 (EMPs) 产生前巨噬细胞 (pMac) 和单核细胞,它们可以分化为长寿命的组织驻留巨噬细胞。相比之下,造血干细胞(HSCs)可以在出生后早期和成年期间产生短寿命和长寿命的巨噬细胞。
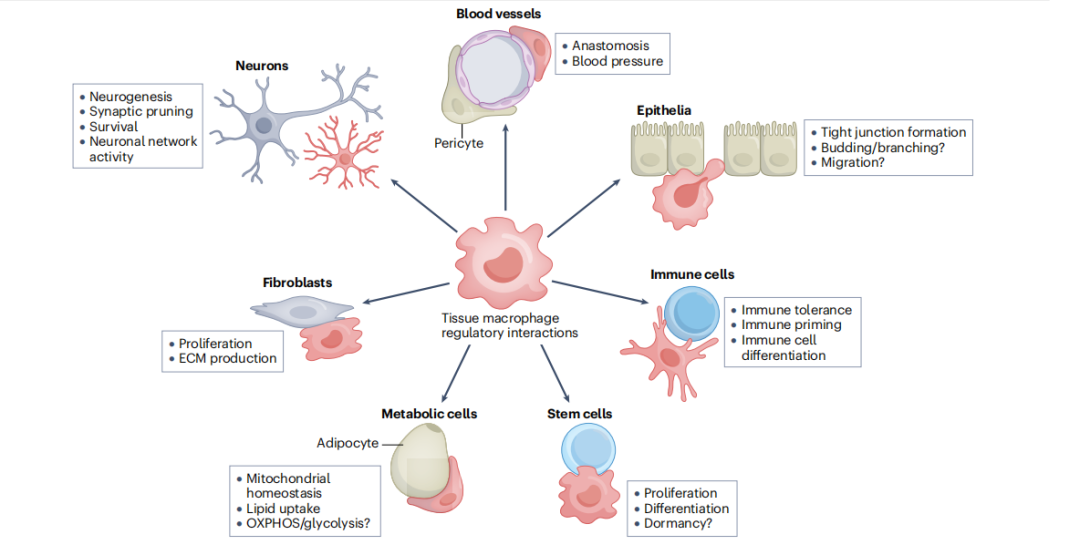
EMP 衍生的和 HSC 衍生的巨噬细胞通过与特殊组织细胞的细胞间串扰来促进组织的功能。组织发育完全依赖于EMP衍生的巨噬细胞。在稳态期间,不同的巨噬细胞亚群与组织细胞相互作用以支持组织功能。在衰老或病理性炎症时,组织中巨噬细胞分布的微调平衡被扰乱,引发例如长寿命巨噬细胞的凋亡,或短寿命 HSC 衍生巨噬细胞的募集增加,从而导致组织功能障碍。

内部组织和屏障组织在器官发生过程中被卵黄囊祖细胞定殖,发育成组织特异性巨噬细胞,居住在器官的不同解剖区域和组织下生态位中。在器官成熟过程中,骨髓红髓系祖细胞 (HSCs) 在某种程度上对某些巨噬细胞群体有贡献,这些巨噬细胞群体具有较高的自我更新能力,因此在组织生态位中具有较长的驻留时间,例如中枢神经系统。
神经系统(CNS)相关巨噬细胞、肝被膜巨噬细胞、真皮巨噬细胞和肺间质巨噬细胞。破骨细胞寿命很长,但随着时间的推移,它们的胎儿来源的细胞核会交换为单核细胞来源的细胞核。此外,某些组织(例如大脑、皮肤、肺和肠)中的成体单核细胞不断补充一定比例的短命巨噬细胞。

器官特异性免疫
巨噬细胞通过与特殊组织细胞的细胞间串扰来促进组织的功能。其中一些功能是众所周知的,例如小胶质细胞与神经元的相互作用,这对于神经发育和功能至关重要。
生理性炎症与病理性炎症
01
巨噬细胞是遍布全身的免疫细胞,负责检测和消灭入侵的微生物病原体。为了有效检测感染,巨噬细胞配备了一系列受体,可以识别病原体,包括通过模式识别、补体或Fcγ受体(FcγRs)调理病原体。此外,巨噬细胞是补体成分C1q等传感蛋白的主要来源,它们在与调理病原体结合后启动促炎补体级联反应。
肠道、皮肤和肺等组织不断地接收外部的免疫刺激信号,并由器官内的巨噬细胞群体进行感知。因此,理解组织中的巨噬细胞群体如何将非致病性的炎症信号纳入其核心功能程序是至关重要的。对环境刺激的生理适应对于保持器官内部环境的稳定、有效清除病原体以及在炎症消退后重建内环境稳定都起到了关键作用。最近的一些研究已经显示,这种适应事件在小鼠模型中具有重要性。例如,肺部潜在的或急性病毒感染与屋尘螨诱导的变态反应增强以及针对继发性细菌更有效的免疫反应有关。
虽然我们尚不清楚在生理炎症过程中,组织内巨噬细胞确切的活跃分子线索。但有趣的是,慢性炎症性疾病如纤维化或肥胖,表现出巨噬细胞核心功能失调的特征,如脂肪细胞或成纤维细胞增殖的代谢紊乱,这些过程通常受到巨噬细胞的严格调控。因此,炎症后巨噬细胞调节回路可能是维持组织稳态和功能的重要调节因子,生理炎症过程的失调可能对易感宿主的慢性炎症的发展产生重要影响。
巨噬细胞核心功能与自身免疫的联系
02
在未受感染的情况下,巨噬细胞因其独特的空间分布而在器官中扮演着消除潜在有害因素的重要角色,以防止触发炎症或自身免疫反应。这包括清除死亡细胞(排异作用),主要在初级和次级免疫器官的正向或负向选择过程中产生,例如胸腺、脾脏、骨髓和淋巴结。此外,由于组织经常暴露于无菌损伤,如紫外线或自然电离辐射,巨噬细胞也负责清除这些损伤产生的细胞碎片。
在像关节这样的组织中,持续的机械应力会导致软骨组织受到持续且可逆的损伤,释放出的细胞碎片和滑液中的成分(如透明质酸)可以与模式识别受体结合。同样,低亲和力多反应性天然抗体或低水平自身反应抗体形成的小免疫复合物广泛存在于健康人体内,为防止它们在肾脏或肺等器官中沉积,必须迅速清除它们,这可能导致补体途径的激活或激活驻留巨噬细胞上大量表达的FcγRs。
重要的是,这种持续的管家功能必须在不触发巨噬细胞活化的状态下运行,因此不会引发炎症。如果核心功能如吞噬活性或调节巨噬细胞活性的检查点出现失调或损伤,巨噬细胞在消除这些潜在有害线索的重要性将变得明显。实际上,巨噬细胞吞噬能力的降低与小鼠和人类系统性红斑狼疮的发生有关。如果巨噬细胞未能及时清除凋亡细胞,细胞将从凋亡过渡到坏死或坏死,这是一种具有免疫原性的细胞死亡形式,会引发组织炎症,并可能最终导致自身抗体反应的启动。从机制上来说,坏死细胞通过巨噬细胞上的不同激活受体被识别,如巨噬细胞诱导的C型凝集素(Mincle)或Toll样受体,这将导致促炎细胞因子的分泌和单核细胞以及中性粒细胞的募集。
大多数关于巨噬细胞功能、个体发育和疾病影响的现有知识都是在先进的转基因小鼠模型的帮助下收集的。使用体内命运图谱和基因缺失研究模型可以了解组织驻留巨噬细胞的基本概念并阐明潜在的新治疗途径。尽管如此,所使用的转基因小鼠模型与人类潜在的治疗应用之间仍存在很大差距。这些例子之一是大多数实验使用无特定病原体的小鼠,没有考虑人类微生物组的多样性及其对免疫和巨噬细胞功能的影响。与使用无特定病原体的小鼠相比,在实验小鼠中引入多样化的微生物组(如在“野生”小鼠中所做的那样)已被证明代表了更接近人类的模型,并且对于巨噬细胞靶向治疗的研究也可能很重要。最近的小鼠研究通过利用集落刺激因子 1 受体的遗传或药理学抑制作用,使用巨噬细胞替代模型进行了研究,这些研究显示出有望应用于患者,例如在神经退行性疾病期间替代功能失调的小胶质细胞。最后,尽管在人源化小鼠中可以重现人类免疫系统的发育,但人类巨噬细胞上的特定生态位印记将源自小鼠组织。总之,尽管目前所有可用的模型系统都有一些特定的好处,但这两种模型都没有完全概括人类的情况,支持需要跨物种方法来表征健康和疾病期间的巨噬细胞核心功能,并在未来的转化方法中利用这些知识。
扫描下方二维码
即可免费获取
常见组织驻留巨噬细胞的marker


参考文献
Mass E, Nimmerjahn F, Kierdorf K, Schlitzer A. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nat Rev Immunol. 2023 Sep;23(9):563-579. doi: 10.1038/s41577-023-00848-y. Epub 2023 Mar 15. PMID: 36922638; PMCID: PMC10017071.
Bibliometric analysis was performed using the citexs website (https://www.citexs.com/).
https://www.thermofisher.cn/cn/zh/home/life-science/cell-analysis/cell-analysis-learning-center/immunology-at-work/macrophage-cell-overview.html
加入社群


关于福麦斯









