免疫细胞铁死亡:肿瘤微环境中的新挑战

铁死亡是由过氧化脂质积累驱动的一种独特的细胞死亡形式。铁死亡以氧化还原脂质代谢的改变为特征,与多种细胞过程有关,包括癌症。诱导铁死亡被认为是杀死肿瘤细胞,特别是对放射和化疗具有抵抗力的细胞的新方法。然而,近年来,出现了一种新的范式。除了促进肿瘤细胞死亡外,铁死亡还通过影响先天性和适应性免疫反应,在肿瘤微环境(TME)中引起有效的免疫抑制。
当细胞膜中的特定多不饱和脂肪酸(PUFA)发生过氧化时,会导致铁死亡。这一过程涉及脂肪酸转化为乙酰辅酶A(CoA),然后通过多种酶,如ACSL4和LPCAT3等,进一步转化为过氧化形式。然而,阻止这些脂质积累的自然机制受到损害。谷胱甘肽过氧化物酶4(Gpx4)和谷胱甘肽抑制脂质ROS的积累,但还有其他不依赖Gpx4的机制也参与其中。
此外,铁死亡抑制蛋白FSP1/CoQ10、DHODH、GCH1/BH4以及GCH1/BH4/IL4I1等也参与调节氧化还原生物学。这些过程涉及不稳定的铁池、促进脂质过氧化的Fenton反应以及调节铁丰度的吞铁蛋白。此外,内过氧化化合物与铁的反应也可能导致铁死亡。

最近的进展进一步说明了诱导癌细胞铁死亡的治疗潜力。因此,许多研究调查了利用诱导癌症铁死亡的治疗潜力的方法,特别是间充质来源的细胞,其对铁死亡表现出更高的敏感性。
然而,铁死亡在肿瘤进展中的作用并不直接。与这种范式相反,该领域的最新进展阐明了铁死亡对TME抗肿瘤免疫反应的负面影响。这些发现提出了一个基本问题:铁死亡在免疫细胞中发挥什么作用,以塑造宿主对癌症的免疫反应。

巨噬细胞、髓系抑制细胞(MDSCs)、中性粒细胞、单核细胞、树突状细胞(DC)和自然杀伤(NK)细胞是固有免疫系统中参与肿瘤进展调控最活跃的细胞。
固有免疫在癌症中具有双重作用。一方面,它通过抗原递呈和细胞因子支持以及直接的抗肿瘤活性来支持适应性肿瘤特异性T细胞反应。另一方面,固有免疫系统的细胞通过释放各种细胞因子,在免疫抑制和促进肿瘤生长方面发挥重要作用。近年来,有证据表明,铁死亡在调节固有免疫系统的细胞功能方面起着重要作用。

中性粒细胞/PMN-MDSCs
中性粒细胞是利用经典骨髓细胞激活来抵抗微生物感染的第一道防线。中性粒细胞在肿瘤发生和肿瘤生长的早期阶段可能具有直接和间接的抗肿瘤作用。与此同时,肿瘤源性信号改变骨髓生成,导致中性粒细胞病理激活扩张,称为“多形核-MDSC”(PMN-MDSC)。这些细胞抑制抗肿瘤免疫反应,包括T细胞、B细胞和NK细胞介导的免疫反应。TME中PMN-MDSC的铁死亡似乎也在免疫抑制中发挥着重要作用,这种作用是通过氧化脂质的释放介导并由FATP2促进的。这导致小鼠多种不同肿瘤模型中肿瘤生长的促进。铁死亡特征与不同类型癌症患者的不良临床结果相关。因此,针对癌症中的铁死亡需要仔细平衡TME中这种细胞死亡机制的抗肿瘤和促肿瘤特征。
单核细胞/M-MDSCs/巨噬细胞
单核细胞和单核(M)-MDSC遵循与上述中性粒细胞/PMN-MDSC相同的经典和病理激活细胞范例。这些主要是在组织中分化为巨噬细胞的循环细胞。它们可以通过激活T细胞和肿瘤相关巨噬细胞(TAM)来促进抗肿瘤免疫,TAM可以吞噬肿瘤细胞,从而支持抗肿瘤作用。然而,这些细胞最主要的活性是通过分泌各种介质以及促进血管生成和转移来促进肿瘤进展。免疫抑制是单核M-MDSC和TAM的主要特征。研究表明,与源自经典单核细胞的TAM相比,源自M-MDSC的TAM保留了其免疫抑制活性。TAM具有高度可塑性,反映了这些细胞可以呈现的表型、代谢和功能特征的范围,包括促炎(M1)到抗炎(M2)状态。鉴于有证据表明靶向这些细胞作为逆转免疫抑制性TME的潜在有前途的策略,正在研究M2 TAM 的消除或复极化为M1。与PMN-MDSC相比,TME中的这些细胞群显示出较少的自发性铁死亡的证据。TAM对铁死亡表现出不同程度的敏感性,在发生铁死亡时可能具有更强的免疫抑制功能。具有M2特性的TAM产生较低水平的iNOS和NO;由于NO自由基可以与脂质过氧化产生的脂质代谢物反应来抑制铁死亡,这使得M2 TAM更容易受到铁死亡的影响。TAM的脆弱性使得可以通过靶向TAM来增强当前细胞免疫疗法的功效。通过将M2 TAM复极化为M1 TAM来靶向铁死亡可能是针对TAM铁死亡的一种治疗途径。
DC细胞
DC是专业的抗原呈递细胞(APC),充当先天性免疫系统和适应性免疫系统之间的信使,处理抗原并将其呈递给T细胞以诱导T细胞激活和效应细胞分化。癌症中DC的功能障碍与肿瘤进展相关。先前的研究表DC功能障碍与脂质积累有关。然而,铁死亡在DC功能中的作用尚不清楚。一些研究表明铁死亡会对DC产生负面影响,从而抑制适应性免疫反应。
NK细胞
NK细胞在肿瘤免疫监视中的作用已得到充分证实,并且它们与从原发肿瘤和远处部位消除肿瘤细胞有关。最近的一项研究表明,肿瘤相关的NK细胞表现出铁死亡的特征,伴有脂质过氧化和氧化损伤。这与TME中NK细胞葡萄糖代谢受抑制以及随之而来的NK细胞功能障碍有关,而NRF2的激活可调节多种抗氧化剂分子的表达,从而挽救这种功能。使用 liproxstatin-1抑制体内铁死亡可增加肿瘤NK细胞存活。这些研究表明铁死亡在TME中NK细胞的存活和功能中具有促肿瘤作用。
T细胞
T细胞是抗肿瘤功能的关键细胞,它们的募集和激活有助于通过利用不同的肿瘤细胞杀伤机制来充分发挥免疫疗法的治疗潜力。与 CD8+ T细胞相关的铁死亡的早期研究报告了铁死亡的治疗益处。CD8+ T细胞可以通过释放IFN-γ发挥抗肿瘤活性,IFN-γ使癌细胞对铁死亡敏感。然而,铁死亡在T细胞中的作用仍知之甚少。一项全面的筛选研究首先确定了肿瘤相关CD8+ T细胞对铁死亡的代谢脆弱性;在这项研究中,活化的CD8+ T细胞比癌细胞对铁死亡诱导剂(GPX4 抑制剂)更敏感。同样,另一项研究报道了TME中CD8+ T细胞中 CD36 表达的增加如何导致脂肪酸摄取,从而诱导脂质过氧化以激活铁死亡;这随后损害了效应T细胞功能和抗肿瘤能力。最近强调了邻近免疫细胞铁死亡对CD8+ T细胞的免疫学影响。这项研究证明了CD8+ T细胞附近的邻近免疫细胞中发生铁死亡的负面影响,显示了小鼠和癌症患者TME中发生铁死亡的PMN-MDSC如何抑制肿瘤相关T细胞功能 。因此,TME中复杂的细胞间相互作用可能会影响免疫细胞和癌细胞的铁死亡敏感性。
与CD8+ T细胞相反,铁死亡在CD4+ T细胞功能中的作用仍然难以捉摸。虽然这些细胞的一个亚群(Treg)与肿瘤特异性CD8+ T细胞相比,对铁死亡的脆弱性较小,但当Treg被激活时,GPX4的缺失会降低其免疫抑制功能,而铁死亡抑制剂可以恢复免疫抑制功能。因此,在考虑铁死亡诱导剂和抑制剂在癌症治疗中的治疗潜力时,评估癌症类型的铁死亡脆弱性并确定TME是否被T细胞浸润可能是必要的。
B细胞
最近的一项研究表明,B1和边缘区B细胞(而非滤泡B2细胞)需要GPX4来防止脂质过氧化和铁死亡。这表明铁死亡与B细胞存活及其在癌症中的潜在功能有关。然而,这一领域仍有待探索。
自从2012年人们认识到铁死亡是一种细胞死亡机制以来,人们广泛致力于开发针对癌细胞的铁死亡诱导药物。如上所述,对铁死亡的更详细分析正在出现,强调了其在TME免疫区室中的差异反应。
随着铁死亡在免疫细胞(特别是PMN-MDSC)中作用的最新发现,需要考虑新的方法来靶向铁死亡。铁死亡相关基因的表达谱分析可以对风险组进行分层。PMN-MDSC中的高铁死亡特征与多种人类癌症的不良预后显着相关,并支持病理性中性粒细胞的细胞特异性靶向的临床相关性。
因此,更好地了解铁死亡在不同细胞类型中的后果对于其药理学研究非常重要。目前,铁死亡的靶向包括对细胞类型没有选择性的小分子和纳米颗粒,鉴于最近出现的免疫系统细胞数据,这可能会导致意想不到的后果。
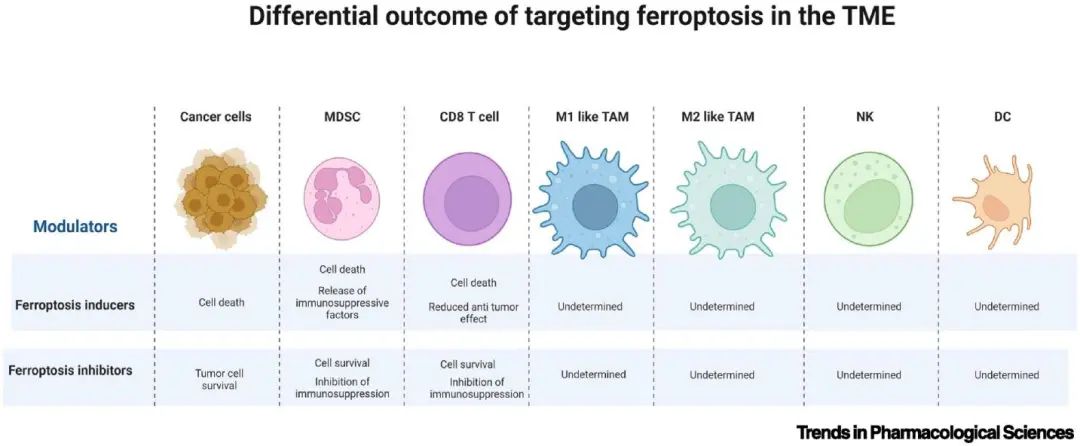
在癌症中,铁死亡是一把双刃剑,有可能根据细胞和肿瘤类型抑制或促进肿瘤生长。虽然引发铁死亡的整体机制及其生理相关性尚不清楚,但肿瘤细胞中这种受调节细胞死亡形式的积极结果之一是释放损伤相关分子模式 (DAMP) 信号,该信号可以促进抗肿瘤免疫。
有人提出,铁死亡肿瘤细胞被膜氢过氧化物标记为巨噬细胞介导的吞噬作用,其充当“吃我”信号,允许其被清除并维持组织稳态。
然而,相比之下,铁死亡肿瘤细胞以及铁死亡免疫细胞可以释放非常有效的免疫抑制因子PGE2和其他氧化磷脂,例如15-氢过氧二十碳四酸(15-HpETE-PE),对抗肿瘤免疫产生负面影响。然而,铁死亡引起的免疫抑制的确切机制仍然知之甚少,其阐明将为更好的靶向机会提供。
另一个关键问题是铁死亡是否独立发生在TME中的所有细胞中,还是首先发生在最脆弱的细胞(例如PMN-MDSC)中,然后转移到其他TME细胞。了解这个问题将澄清TME中应选择性靶向的细胞。铁死亡在TME中的双重作用可能需要通过仅保护该环境中的免疫细胞来靶向诱导肿瘤细胞中的铁死亡。
铁死亡抑制与检查点阻断相结合,在多种肿瘤模型中显示出对肿瘤生长的强烈抑制;因此,更具侵袭性的肿瘤可能需要联合治疗。人们可以考虑在铁死亡抑制的基础上同时靶向MDSC和TAM MDSC,以更好地灭活抑制性TME。
自发现以来,铁死亡领域发展迅速,揭示了铁死亡的复杂性质及其在包括癌症在内的各种病理学中的参与。平衡铁死亡在肿瘤细胞、抗肿瘤免疫细胞和免疫抑制细胞中的双重作用对于扩大铁死亡作为抗癌治疗的应用至关重要。
扫描二维码
免费领取铁死亡检测方法


参考文献:Kim R, Taylor D, Vonderheide RH, Gabrilovich DI. Ferroptosis of immune cells in the tumor microenvironment. Trends Pharmacol Sci. 2023 Aug;44(8):542-552. doi: 10.1016/j.tips.2023.06.005. Epub 2023 Jun 27. PMID: 37380530.
加入社群


关于福麦斯









