国自然热点 | Treg细胞复杂的亚群分类及检测方案!

调节性T细胞(Treg)作为免疫抑制性细胞群,通过调控过度免疫应答和维持免疫稳态发挥核心作用。根据Treg的来源与功能,其又能被进一步细分。

01.
基于CD45RA表达分类
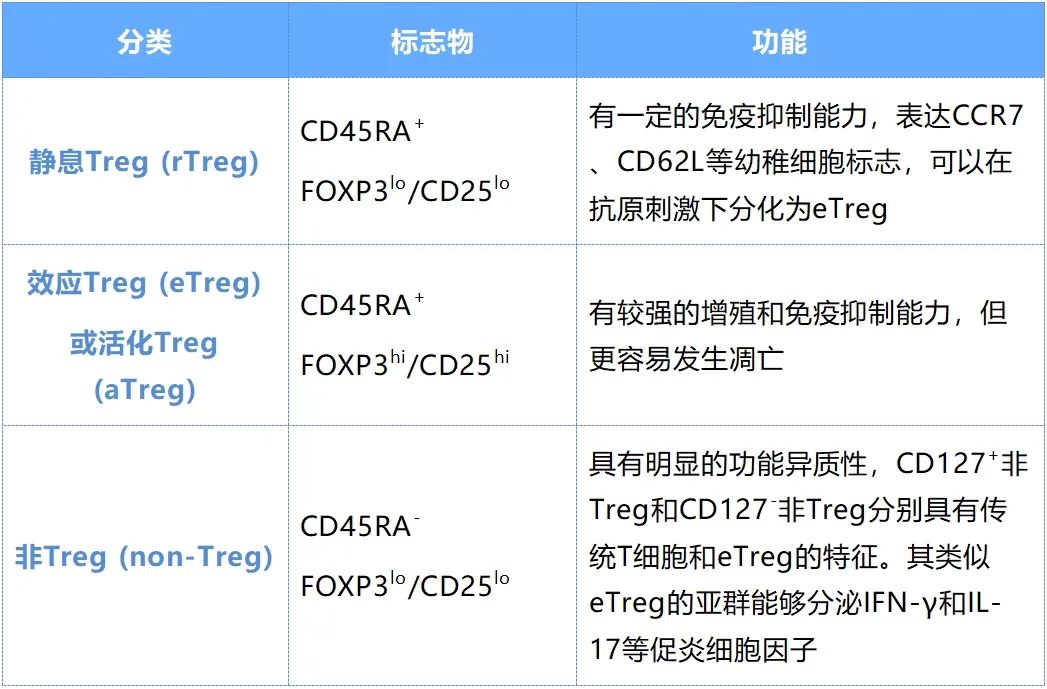
基于CD45RA表达,Treg可分为静息Treg (rTreg)、效应Treg (eTreg) 或活化Treg (aTreg)、非Treg (non-Treg),该分类方法已被广泛用于研究肿瘤微环境中CD4+ Treg细胞的异质性。
02.
基于细胞因子分泌和转录因子表达分类
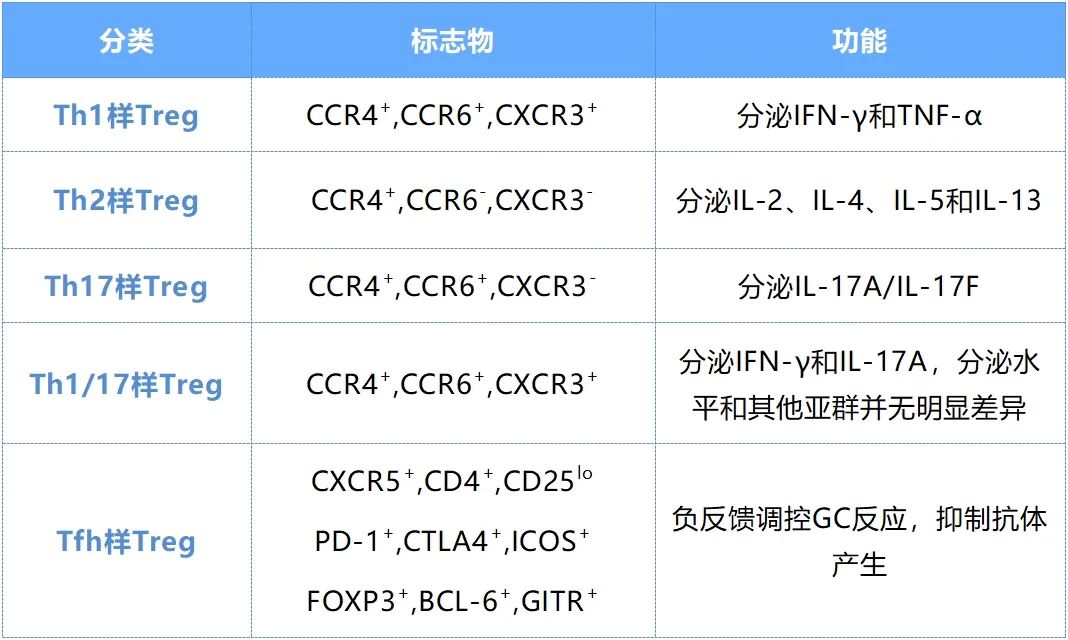
根据细胞因子分泌和转录因子表达情况,Treg可分为Th1样Treg、Th2样Treg、Th17样Treg、Th1/17样Treg、Tfh样Treg,这些也被称为Th样Treg。该分类方式没有考虑Foxp3在不同亚型中表达的稳定性,从而无法准确把握各亚群的实际功能作用,因此在各种研究中会得出不同的结果。
03.
CD4+Treg细胞来源和稳定表达Foxp3分类
稳定表达Foxp3的CD4+Treg细胞可能具有免疫调节能力,而表达不稳定的Foxp3细胞在微环境影响下可能向其他类型的T细胞转化。结合CD4+ Treg细胞的来源和Foxp3表达,还可以将CD4+ Treg亚群分类为nTreg/tTreg、iTreg等亚群。

04.
肿瘤微环境中的Treg分类
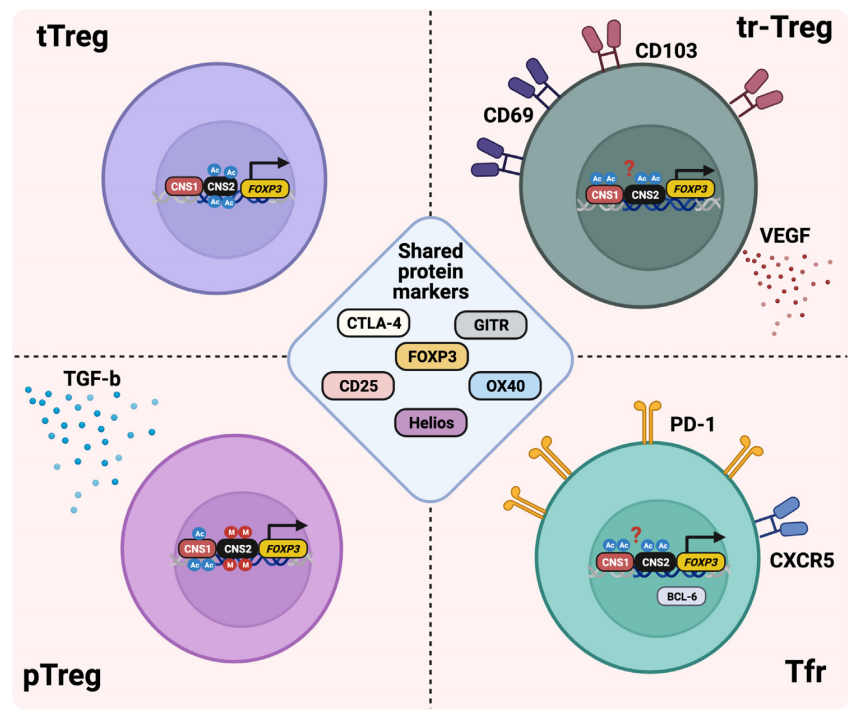
在肿瘤微环境中,Treg细胞包含多个亚群,这些亚群的分类依据是其来源和功能的专门化,且它们共同构成了肿瘤内部的Treg细胞库。在肿瘤微环境(TME)中,最为显著的Treg亚群包括胸腺来源的Treg(tTreg)、外周诱导的Treg(pTreg)、组织驻留的Treg(tr-Treg)以及滤泡Treg(Tfr)。这些不同的亚群均表达Treg的主要调节蛋白Foxp3,并共享一系列典型的Treg特征标记,如CD25和CTLA-4,用以支持其抑制功能,同时它们也各自展现出独特的特性。
👉🏻 点这里了解肿瘤微环境形成机制、完整构成及其功能!
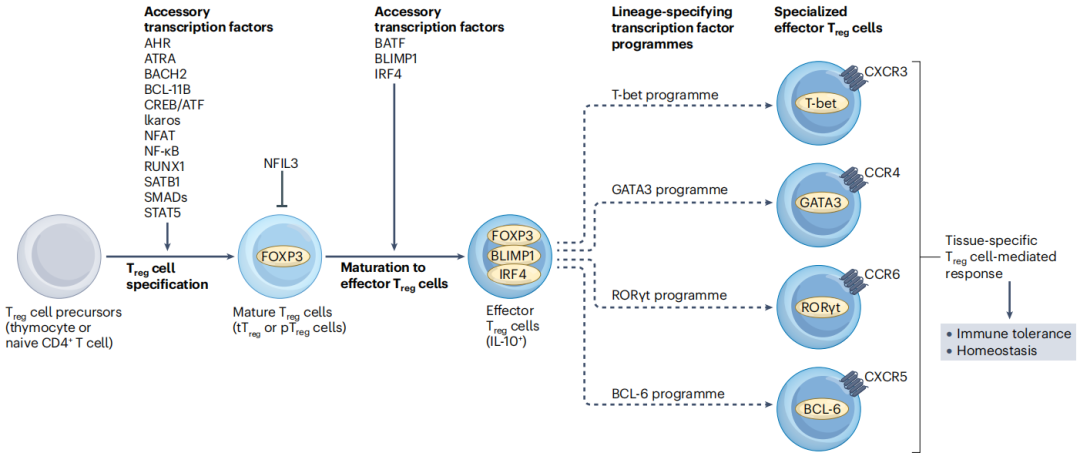
在胸腺或其他免疫微环境中,naive CD4+ T细胞通过TCR信号激活,并在IL-2及TGF-β等可溶性因子的协同作用下,启动向Treg细胞的分化程序。这一过程依赖于多个辅助转录因子的协同作用,它们共同调控Treg细胞的命运决定和表观遗传修饰(如Treg细胞特异性脱甲基化区域的建立),从而确保FOXP3的稳定表达。
05.
转录因子对Treg细胞的调控
Treg细胞进一步分化为效应性Treg细胞的过程受到FOXP3依赖性和FOXP3非依赖性转录因子的双重调控。这些因子不仅能促进FOXP3的表达,还能增强抑制性细胞因子的产生。然而,某些转录因子(如NFIL3)可抑制FOXP3的表达,从而精细调节Treg细胞的功能。

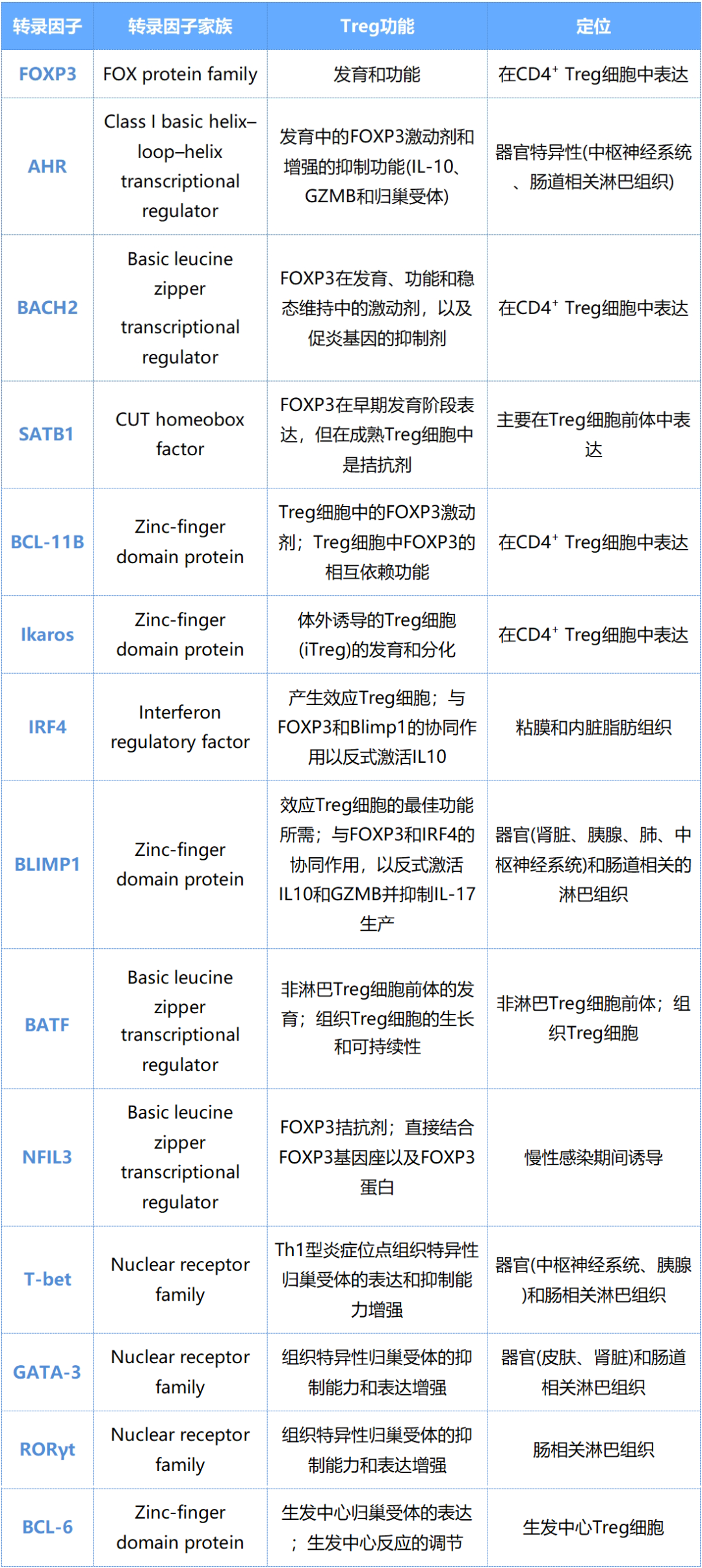
成熟的效应性Treg细胞还能激活额外的转录程序,这些程序通常由调控常规T细胞分化的转录因子驱动。这些机制赋予Treg细胞独特的亚群特征,例如组织归巢能力的形成,使其能够适应不同的免疫微环境并发挥特异性调控功能。
📍 Treg细胞的分化及FOXP3的表达受多重信号协同调控:

1
核心激活信号:
①TCR-MHC II抗原识别:抗原呈递细胞通过MHC II-抗原复合物激活TCR;
②IL-2-CD25/STAT5通路:IL-2通过CD25-STAT5信号模块传递增殖与分化信号;
③TGFβ-SMAD经典通路:介导Treg细胞谱系定向分化。
2
微环境信号整合:
环境中的细胞因子及内源性化合物(如色氨酸代谢物)通过特定受体(如AHR、RORγt)被感知,进一步调控Treg细胞的可塑性。
3
转录调控网络
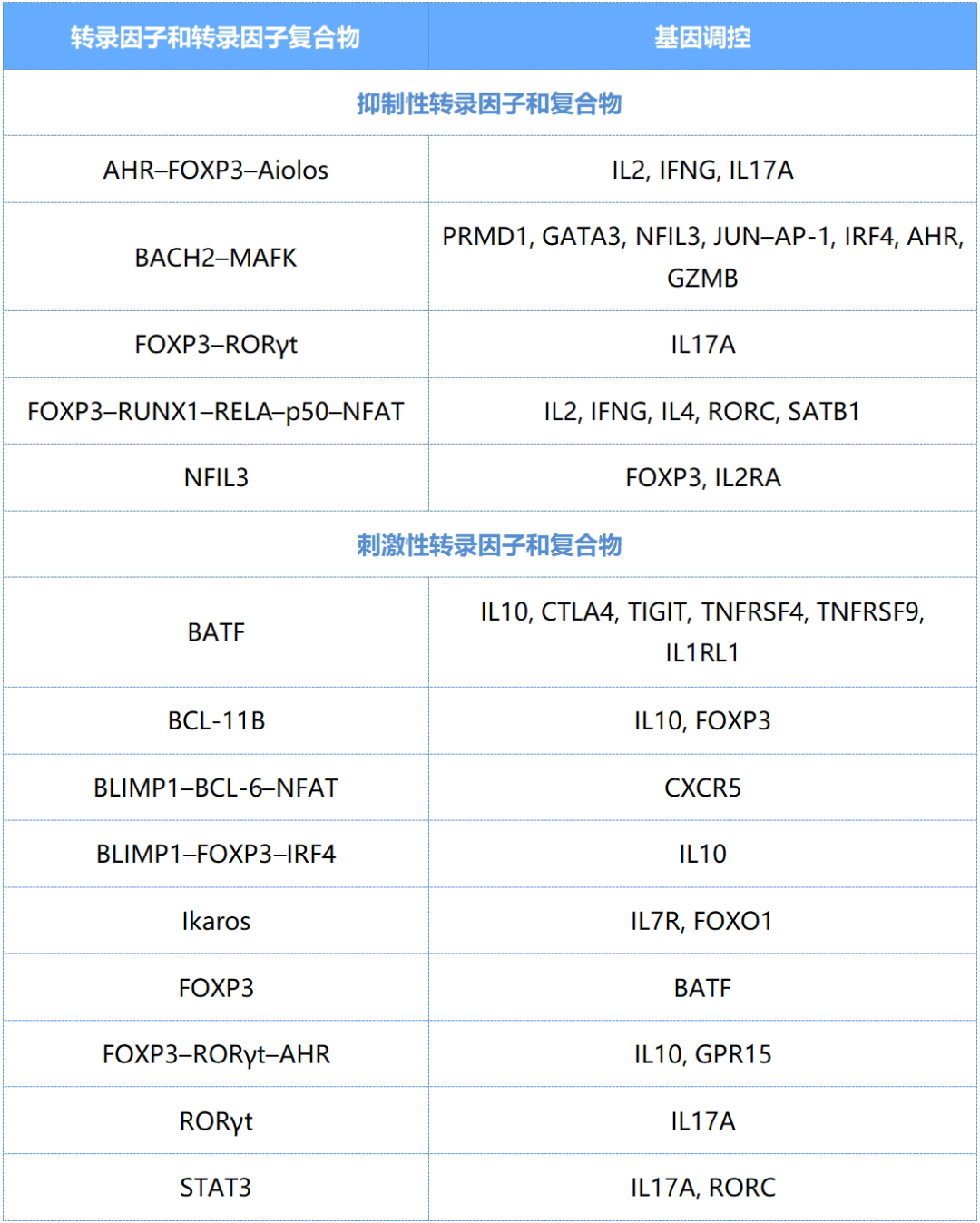
在FOXP3基因的保守非编码区(CNS),多种转录因子(如BACH2、MAFK、Ikaros家族蛋白、RUNX1、FOXO1、SATB1及NFIL3)形成动态复合物,通过以下机制精确调控Treg功能:
①稳定FOXP3表达;
②启动抑制性功能程序(包括细胞接触依赖机制和可溶性因子分泌)。
在Treg细胞分化过程中,转录相互作用导致抑制性和刺激性转录因子和复合物的瞬时组装,它们独立地或与FOXP3一起抑制或诱导参与维持标志性调节性T细胞基因和组织内特定功能的基因的表达。
06.
Treg的流式检测
赛尔普 Treg 流式细胞术检测服务 ,仅需提供样本,享受一站式服务体验(样本制备→处理→抗体染色→分析),每支抗体精选挑选,确保最好的流式结果!(服务详情可咨询文末小助手)



07.
Treg资料分享
更详细的Treg Protocols,大家可以扫码添加小助手小麦,回复“0402”下载资料!


福麦斯小助手-小麦
参考文献
END
加入社群

关于福麦斯









